Ein besonderer Fokus liegt im laufenden Jahr auf der Nachjustierung und Anpassung von Regelungen im Rahmen von intendierten Vereinfachungen, einschließlich der Absenkung bürokratischer Hürden. Daneben treten aber auch substanzielle neue Anforderungen und Veränderungen der Rechtsgrundlagen, wie etwa durch das bereits erfolgte Inkrafttreten des „One Substance, one assessment“-Pakets. Besondere Praxisrelevanz wird zudem weiteren Rechtsänderungen zukommen, die auf die Korrektur regulatorischer Fehlentwicklungen gerichtet sind. Der nachstehende Beitrag greift einige der relevanten Änderungen im Anwendungsbereich verschiedener chemiekalienrechtlicher Rechtsakte auf.
A. REACH
Auch wenn der Vorschlag der Europäischen Kommission für eine Überarbeitung der Verordnung (EG) Nr. 1907/2006 („REACH“) weiterhin auf sich warten lässt, gibt der bestehende Rechtsrahmen erneut Raum für vielfältige neue Anforderungen. Vor allem das Verfahren zur Beschränkung von PFAS wird dabei im Zentrum des Interesses stehen.
I. Revision
Die zielgerichtete Überarbeitung von REACH steht weiter auf der Agenda. Nicht zuletzt aufgrund der vielfältigen Anpassungen durch sog. Omnibus-Vorschläge der Kommission im vergangenen Jahr sind reguläre Revisionsprozesse, wie etwa zu REACH, weiteren Verzögerungen ausgesetzt. So hat die Kommission etwa im Zusammenhang mit dem sog. Umwelt-Omnibus vom 10.12.2025 nur noch sehr sparsam festgehalten, dass eine gezielte Revision von REACH beabsichtigt ist. Weitere Ankündigungen zum Zeitplan liegen derzeit jedoch noch nicht vor.
Beachtlich ist aber mindestens, dass die Kommission die REACH Revision offenbar auch dazu nutzen will, weitere Möglichkeiten für Vereinfachungen zu prüfen und entsprechende Ansätze ggf. mit ihrem Vorschlag verbinden will. Angesichts der noch unter dem Green Deal entwickelten Ansätze und der zuletzt weiterverfolgten, durchaus ambitionierten Überlegungen der Kommission für eine Anpassung von REACH bleibt aber doch fraglich, ob und ggf. inwieweit die REACH Revision tatsächlich Vereinfachungen mit sich bringen wird.
II. Stoff- und Dossierevaluierung
Der Entwurf des Community Rolling Action Plan (CoRAP) für 2026-2028 wurde am 09.12.2025 vorgelegt und wird derzeit finalisiert. Eine Verabschiedung ist im Rahmen des nächsten Member State Committee Meetings (voraussichtlich vom 09.-13.02.2026) vorgesehen. Der Entwurf des CoRAP enthält 28 Stoffe, darunter 8 neue Stoffe im Vergleich zum aktuellen CoRAP 2025-2027.
Betroffene Unternehmen sollten sich mit den stoffspezifisch identifizierten Gründen für eine Besorgnis auseinandersetzen, ihre jeweiligen Registrierungsdossiers überprüfen und nötigenfalls aktualisieren.
III. Zulassung
Parallel zu laufenden Diskussionen und Verfahren zu generellen Änderungen, entwickelt sich die stoffbezogene Regulierung unter der REACH-Verordnung unaufhaltsam weiter.
1. SVHC Identifizierung
Die ECHA hat zuletzt unter dem 05.11.2025 eine Aktualisierung der Kandidatenliste vorgenommen und mit 1,1′-(ethane-1,2-diyl)bis[pentabromobenzene] (DBDPE) (EC: 284-366-9, CAS: 84852-53-9) einen weiteren Stoff aufgenommen. Seither umfasst die Kandidatenliste insgesamt 251 Einträge, die unmittelbar sowohl für die Kommunikation in der Lieferkette nach Art. 33 REACH wie auch für Meldungen in die SCIP-Datenbank zu beachten sind. Für etwaige Notifizierungspflichten nach Art. 7 Abs. 2 REACH gilt für den zuletzt aufgenommenen Stoff derzeit noch eine Übergangsfrist von weiteren sechs Monaten (vgl. Art. 7 Abs. 7 REACH).
Auch im Jahr 2025 konnte damit festgestellt werden, dass die vormals etablierte Praxis von nur zwei Aktualisierungen binnen 12 Monaten nicht konsequent eingehalten wurde. Wie schon im Vorjahr wurde auch in Jahr 2025 eine zusätzliche Ergänzung im November vorgenommen. Es zeichnet sich insofern ein Trend ab, der auf drei Ergänzungen der Kandidatenliste pro Kalenderjahr ausgerichtet ist.
Die erwartbare Ergänzung der Kandidatenliste per Anfang 2026 steht derzeit noch aus. Nach der Beschlusslage auf Ebene des Member State Committees soll der Stoff n-Hexane (EC No 203-777-6) als SVHC identifiziert und in die Kandidatenliste aufgenommen werden. Die Aktualisierung der Kandidatenliste ist für den 04.02.2026 vorgesehen. Die zunächst ebenfalls noch vorgesehene Identifizierung von 4,4’-methylenediphenol (EC No 210-658-2) als SVHC wurde noch vor der Sitzung des Member State Committees im Dezember 2025 zurückgezogen.
Weiterhin gilt, dass betroffene Unternehmen durch die kontinuierliche Änderung der Kandidatenliste vor Herausforderungen gestellt werden. Denn Kommunikationsprozesse in der Lieferkette müssen mit jeder Änderung auf Aktualität und inhaltliche Vollständigkeit überprüft werden.
2. SCIP-Datenbank
Im Zusammenhang mit der Zulassungskandidatenliste ist darüber hinaus beachtlich, dass die Europäische Kommission mit dem Umwelt-Omnibus den Vorschlag vorgelegt hat, die Meldepflicht für Informationen zu SVHC in die sog. SCIP-Datenbank abzuschaffen. Es ist einerseits zwar zu begrüßen, dass die von der Industrie seit geraumer Zeit betonten Unzulänglichkeiten der bestehenden Meldepflichten und der Datenbank damit eingeräumt werden. Andererseits sollte der Vorschlag der Europäischen Kommission auch ein Signal an den Gesetzgeber sein, die Folgen und den Nutzen zusätzlicher Anforderungen vor der Einführung neuer Rechtspflichten sorgfältiger zu prüfen.
Die Gewährleistung von Informationstransparenz soll nach den Vorstellungen der Europäischen Kommission künftig v.a. über den Digitalen Produktpass gewährleistet werden. Es bleibt abzuwarten, ob der damit verbundene Aufwand für die Industrie und der Nutzen durch weitergehende Transparenz in der Lieferkette in einem angemessenen Verhältnis stehen werden.
3. Zulassungspflichten
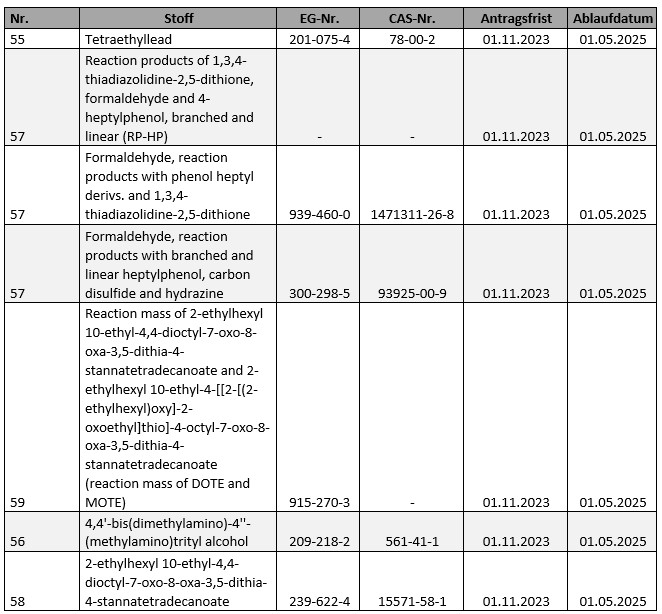
Insgesamt vier Stoffe wurden mit der 12. Empfehlung zur Aufnahme von Stoffen in den Anhang XIV zu REACH von der ECHA vorgeschlagen; eine Entscheidung der Kommission steht insofern aber noch aus. Betroffen sind:
| Stoff | EC | CAS |
| Barium diboron tetraoxide | 237-222-4 | 13701-59-2 |
| Diphenyl(2,4,6-trimethylbenzoyl)phosphine oxide | 278-355-8 | 75980-60-8 |
| S-(tricyclo(5.2.1.0’2,6)deca-3-en-8(or 9)-yl O-(isopropyl or isobutyl or 2-ethylhexyl) O-(isopropyl or isobutyl or 2-ethylhexyl) phosphorodithioate X4261 | 401-850-9 | 255881-94-8 |
| Melamine | 203-615-4 | 108-78-1 |
Für die 13. Empfehlung zur Aufnahme von Stoffen in den Anhang XIV zu REACH hat zuletzt das Member State Committee die Vorschläge der ECHA diskutiert. Aktuell sind danach vier Stoffe für die Aufnahme vorgesehen:
- UV-326
- UV-329
- triphenyl phosphate
- 2-(dimethylamino)-2-[(4-methylphenyl)methyl]-1-[4-(morpholin-4-yl)phenyl]butan-1-one
Die dreimonatige Konsultation ist derzeit für Februar 2026 vorgesehen.
Im Übrigen stehen für das Jahr 2026 für zulassungspflichtige Stoffe gemäß Anhang XIV keine Ablauftermin oder Termine für eine Antragstellung an.
IV. Beschränkungen
Auch im Jahr 2026 ändern sich für eine Reihe von bestehenden Beschränkungen die Anforderungen:
1. Eintrag 63 (Blei und seine Verbindungen)
Nach Absatz 15 in Eintrag 63 in Anhang XVII zu REACH betreffend Blei und seine Verbindungen gilt grundsätzlich ein Verkehrsverbot für Erzeugnisse, die aus Polymeren oder Copolymeren des Vinylchlorids („PVC“) hergestellt sind, wenn die Bleikonzentration 0,1 Gew.-% oder mehr des PVC-Materials beträgt. Hiervon sieht Absatz 18 zwar eine verlängerte Übergangsfrist bis zum 28.05.2033 für bestimmte Erzeugnisse vor, wenn die Bleikonzentration weniger als 1,5 Gew.-% des rückgewonnenen Hart-PVC beträgt. Allerdings gilt ab dem 28.05.2026 eine weitergehende Einschränkung. Ab diesem Termin darf Hart-PVC, das aus Profilen und Platten
- für Außenanwendungen in Hoch- und Tiefbauwerken, außer für Decks und Terrassen;
- für Decks und Terrassen, sofern das rückgewonnene PVC in einer mittleren Schicht verwendet wird und vollständig mit einer Schicht aus PVC oder einem anderen Material mit einer Bleikonzentration von weniger als 0,1 Gew.-% bedeckt ist;
- zur Verwendung in verdeckten Bereichen oder Hohlräumen in Hoch- und Tiefbauwerken (soweit sie während der normalen Nutzung nicht zugänglich sind, außer für Instandhaltungszwecke, z. B. Kabelkanäle);
- für Innenanwendungen bei Gebäuden, sofern die gesamte Fläche des Profils oder der Platte, die den belegten Bereichen eines Gebäudes nach dem Einbau zugewandt ist, aus PVC oder einem anderen Material mit einer Bleikonzentration von weniger als 0,1 Gew.-% hergestellt ist,
zurückgewonnen wird, nur für die Herstellung neuer Erzeugnisse einer dieser Kategorien verwendet werden.
2. Eintrag 77 (Formaldehyd)
Ab dem 06.08.2026 findet die Beschränkung betreffend Formaldehyd nach Eintrag 77 in Anhang XVII zu REACH Anwendung. Ab diesem Stichtag dürfen Erzeugnissen nicht mehr in Verkehr gebracht werden, wenn die in Anlage 14 zu Anhang XVII zu REACH genannten Prüfbedingungen die Konzentration an Formaldehyd, das aus diesen Erzeugnissen freigesetzt wird, folgende Werte überschreitet:
- 0,062 mg/m3 für Möbel und Erzeugnisse auf Holzwerkstoffbasis;
- 0,080 mg/m3 für andere Erzeugnisse als Möbel und Erzeugnisse auf Holzwerkstoffbasis.
Die Beschränkung gilt nicht für
- Erzeugnisse, bei denen Formaldehyd oder Formaldehydabspalter ausschließlich natürlich in den Materialien vorkommen, aus denen die Erzeugnisse hergestellt werden;
- Erzeugnisse, die unter vorhersehbaren Bedingungen ausschließlich zur Verwendung im Freien bestimmt sind;
- Erzeugnisse in Bauwerken, die ausschließlich außerhalb der Gebäudehülle und der Dampfsperre verwendet werden und von denen kein Formaldehyd in die Innenraumluft freigesetzt wird;
- Erzeugnisse, die ausschließlich für die industrielle oder gewerbliche Verwendung bestimmt sind, außer wenn aus ihnen freigesetztes Formaldehyd unter vorhersehbaren Verwendungsbedingungen zu einer Exposition der breiten Öffentlichkeit führt;
- Erzeugnisse, für die die Beschränkung gemäß Eintrag 72 gilt;
- Erzeugnisse, die als Biozidprodukte der Verordnung (EU) Nr. 528/2012 des Europäischen Parlaments und des Rates unterliegen;
- Produkte, die in den Geltungsbereich der Verordnung (EU) 2017/745 des Europäischen Parlaments und des Rates fallen;
- persönliche Schutzausrüstungen im Rahmen der Verordnung (EU) 2016/425;
- Gegenstände, die dazu bestimmt sind, mit Lebensmitteln unmittelbar oder mittelbar in Berührung zu kommen, die in den Anwendungsbereich der Verordnung (EG) Nr. 1935/2004 fallen;
- gebrauchte Erzeugnisse.
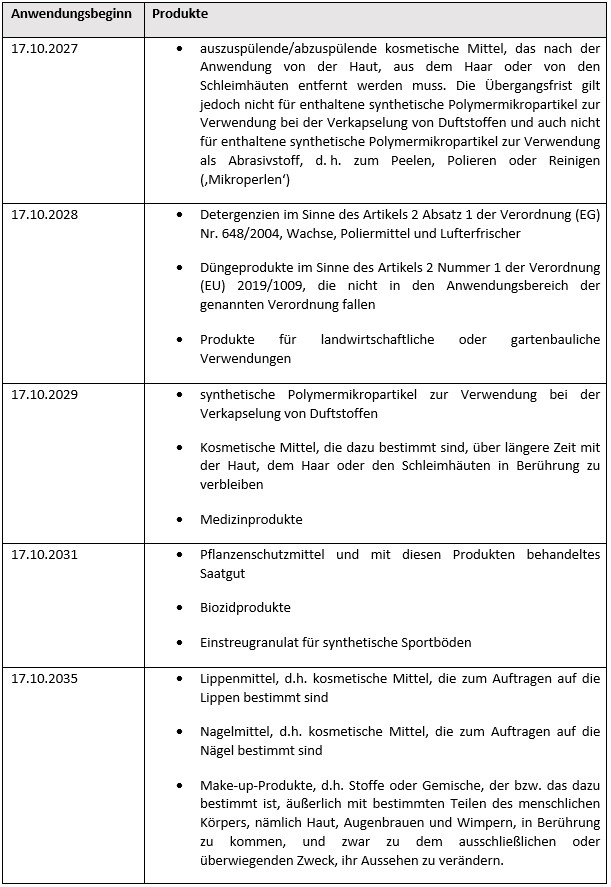
3. Eintrag 78 (Synthetische Polymermikropartikel)
Nach Eintrag 78 in Anhang XVII zu REACH müssen Lieferanten von In-vitro-Diagnostika, einschließlich Produkte im Sinne der Verordnung (EU) 2017/746, die synthetische Polymermikropartikel enthalten ab dem 17.10.2026 Anweisungen für die Verwendung und Entsorgung für gewerbliche Anwender und die breite Öffentlichkeit zur Verfügung stellen, in denen erläutert wird, wie die Freisetzung synthetischer Polymermikropartikel in die Umwelt verhindert werden kann.
Zusätzlich sind zum 31.05.2026 Berichtspflichten nach Absatz 11 zu Eintrag 78 in Anhang XVII zu REACH zu erfüllen. Bis zu dem Termin müssen Hersteller und nachgeschaltete industrielle Anwender von synthetischen Polymermikropartikeln in Form von Granulaten, Flocken und Pulvern, die als Ausgangsmaterial für die Kunststoffherstellung in industriellen Anlagen verwendet werden, für den Berichtszeitraum vom 01.01.2025 bis 31.12.2025
- eine Beschreibung der Verwendungen von synthetischen Polymermikropartikeln;
- für jede Verwendung synthetischer Polymermikropartikel allgemeine Informationen zur Identität der verwendeten Polymere;
- für jede Verwendung synthetischer Polymermikropartikel eine Schätzung der Menge synthetischer Polymermikropartikel, die im vorangegangenen Kalenderjahr in die Umwelt freigesetzt wurden, einschließlich der Menge synthetischer Polymermikropartikel, die während des Transports in die Umwelt freigesetzt wurden;
- für jede Verwendung von synthetischen Polymermikropartikeln einen Hinweis auf die Ausnahmeregelung gemäß Absatz 4 Buchstabe a zu Eintrag 78 in Anhang XVII zu REACH
an die ECHA melden.
4. PFAS
Jenseits der bereits bestehenden Beschränkungen bleibt vor allem das laufende Beschränkungsverfahren betreffend PFAS von zentraler Bedeutung für nahezu alle Industriesektoren. Nachdem die fachliche Bewertung des Beschränkungsvorschlags durch die maßgeblichen Ausschüsse der ECHA, d.h. der Ausschuss für Risikobeurteilung (RAC) und der Ausschuss für sozioökonomische Analyse (SEAC), weitgehend abgeschlossen ist, ist nach aktuellen Ankündigungen ab März 2026 die weitere Konsultation zum Entwurf der SEAC zu erwarten. Für betroffene Unternehmen stellt diese Konsultation die letzte im Verfahren ausdrücklich vorgesehene Möglichkeit dar, durch Einreichung von Informationen Einfluss auf die Gestaltung der künftigen Beschränkung zu nehmen. Nach dem Abschluss der Konsultation wird die ECHA den Beschränkungsvorschlag finalisieren und zur weiteren Entscheidung an die Kommission übermitteln.
5. Chrom VI
Darüber hinaus wird auch das Verfahren zur Beschränkung von Chrom VI weiteren Fortgang finden. Die Europäische Kommission hat eine aktualisierte Version des Q&A-Dokuments „Towards a restriction of hexavalent chromium (Cr(VI)) substances“ veröffentlicht. Die laufenden Zulassungsverfahren und die Entwicklungen zur Beschränkung sollen weiter aufeinander abgestimmt werden. Dazu soll auch der Entwurf eines Durchführungsrechtsakts dienen, der im REACH-Regelungsausschuss beraten wurde: CMTD(2025)2107 – Register zum Ausschussverfahren. Die Stellungnahmen von RAC und SEAC zum Beschränkungsvorschlag werden derzeit bis zum 3. Quartal 2026 erwartet, eine Beschränkung (inkl. Anpassung der Anhänge XIV und XVII) könnte sodann im Laufe des Jahres 2027 angenommen werden.
B. CLP
Bereits Ende 2024 wurden weitreichende Änderungen der Verordnung (EG) Nr. 1272/2008 („CLP“) mit der Verordnung (EU) 2024/2865 eingeführt. Mit Verordnung (EU) 2025/2439 wurde zuletzt allerdings der Geltungsbeginns der Übergangsbestimmungen der Verordnung (EU) 2024/2865 verschoben (vgl. hierzu im Einzelnen bereits unseren Blog-Beitrag).
Die Verschiebung des Geltungsbeginns („Stop-the-clock“) stellt allerdings nur den ersten Teil im Rahmen des Omnibus VI-Pakets „Chemikalien“ dar. In einem zweiten Teil sollen weitergehende inhaltliche Nachjustierungen u.a. in Bezug auf die mit Verordnung (EU) 2025/2439 eingeführten Änderungen vorgenommen werden. Dabei sollen insbesondere Flexibilitäten in Bezug auf Schriftgrößen und Kennzeichnung geschaffen werden. Auch die Ausnahmen von Kennzeichnungspflichten für kleine Gebinde sollen ausgeweitet werden. Darüber hinaus sollen die Vorgaben für die Aktualisierung von Etiketten oder auch die Pflichtangaben in der Werbung geändert werden. Das parlamentarische Verfahren dauert noch an, so dass die weiteren Entwicklungen abzuwarten bleiben.
Im laufenden Jahr steht erstmals die Anwendung des ergänzend eingeführten Art. 37 Abs. 7 CLP an. Mit dieser Regelung wird zur Vermeidung doppelter Bewertungen die Befugnis der Kommission begründet, harmonisierte Einstufungen für solche Stoffe vorzunehmen, die Gegenstand früherer Verfahren zur SVHC-Identifizierung waren oder als Wirkstoffe gem. Verordnung (EU) Nr. 528/2012 bzw. Verordnung (EG) Nr. 1107/2009 bewertet wurden und die danach den neu eingeführten Gefahrenklassen ED HH Kat. 1, ED ENV Kat. 1, PBT oder vPvB unterfallen, ohne dass hierfür ein weiteres Bewertungsverfahren erforderlich wird. Ein erster Vorschlag hierzu liegt vor und umfasst 115 Stoffe. Dabei sind 52 neue Einträge und für 63 Einträge entsprechende Änderungen vorgesehen. Mit einer Veröffentlichung eines delegierten Rechtsaktes zur Änderung von Anhang VI Teil 3 Tabelle 3 zur CLP ist im Laufe des Jahres zu rechnen.
C. BPR
Ein Hauptaugenmerk liegt weiterhin auf der Fortführung des Arbeitsprogramms unter der Verordnung (EU) Nr. 528/2012 („BPR“), nebst entsprechender Fortschreibung und Aktualisierung der maßgeblichen delegierten Verordnung (EU) Nr. 1062/2014. Auf allfällige Fristen für 2026 weist die ECHA in gewohnter Weise hin.
In diesem Zusammenhang sind in weiterhin anhängigen Verfahren auf Wirkstoffgenehmigung bzw. Produktzulassung auch ergänzende Datennachforderungen zu verzeichnen. In besonderer Weise gilt dies für laufende Verfahren betreffend In-Situ-Systeme im Anschluss an die Verabschiedung der „BPC Recommendations“ für die Bewertung derselben.
Besonderes Augenmerk verdient im laufenden Jahr auch der Vorschlag der Kommission, die Datenschutzfristen nach Art. 95 Abs. 5 BPR für alle Wirkstoff-Produktart-Kombinationen zu verlängern, für die eine Entscheidung über die Wirkstoffgenehmigung nicht bis zum 07.06.2018 getroffen wurde. Die verlängerte Frist soll nun am 31.12.2030 enden. Für Daten, die unter Geltung der bisherigen Regelung ab dem 31.12.2025 und bis zum Inkrafttreten der neuen Regelung nicht geschützt waren, sollen berechtigte Dateninhaber einen ergänzenden Ausgleichsanspruch erhalten, soweit die Daten von Dritten entsprechend genutzt wurden. Der Anspruch muss allerdings im Einzelfall durch den Dateneigentümer geltend gemacht und durchgesetzt werden.
Einerseits ist auch hier zu begrüßen, dass die Europäische Kommission die Bereitschaft zeigt, eine greifbare Unschärfe und unbeabsichtigte Fehlentwicklungen in der BPR zu korrigieren. Andererseits wird insofern der bisherige Fehler sogleich wiederholt. Die Dauer des Arbeitsprogramms für alte Wirkstoffe und entsprechende Produktarten wurde mit delegierter Verordnung (EU) 2024/1398 bis 31.12.2030 verlängert, so dass die nunmehr vorgesehene Anpassung der Datenschutzfristen nach Art. 95 Abs. 5 BPR (erneut) passgenau zum vorgesehenen Ende des Arbeitsprogramms ausläuft. Sollte es allerdings zu weiteren Verzögerungen bei der Bewältigung des Arbeitsprogramms kommen, würde per Ende 2030 erneut die schon zum Ende des Jahres 2025 eingetretene Situation bestehen. Eine flexiblere Gestaltung der Datenschutzregelung unter Art. 95 Abs. 5 BPR wäre insofern wünschenswert gewesen. Da die Europäische Kommission eine nochmalige Verlängerung des Arbeitsprogramms über 2030 hinaus unter dem bestehenden Rechtsrahmen aber ohnehin ablehnt, war mit einer flexibleren Gestaltung nicht zu rechnen. Es bleibt abzuwarten, ob im Zuge der weiteren Überprüfung der BPR selbst ggf. ergänzende oder neue Regelungsansätze etabliert werden.
Noch bis zum 05.03.2026 läuft insofern die Konsultation zur möglichen Überarbeitung der BPR – bislang allerdings mit äußerst geringer Beteiligung.
D. POP
Für das Jahr 2026 steht die Aufnahme weiterer Stoffe in Anhang I zur Verordnung (EU) 2019/1021 („POP“) an. Zuletzt hatte die Europäische Kommission MCCPs, Chlorpyrifos und C9-21 PFCAs für die Aufnahme vorgeschlagen und noch Ende 2025 eine entsprechende Konsultation durchgeführt. Es steht zu erwarten, dass der Rechtsakt zur Aufnahme der Stoffe in die POP-Verordnung im Laufe des Jahres 2026 erlassen wird.
E. Datenplattform
Die Verordnung (EU) 2025/2455 zur Einrichtung einer gemeinsamen Datenplattform für Chemikalien und zur Festlegung von Vorschriften, die sicherstellen sollen, dass die darin enthaltenen Daten auffindbar, zugänglich, interoperabel und wiederverwendbar sind, sowie zur Schaffung eines Überwachungs- und Prospektivrahmens für Chemikalien wurde am 12.12.2025 im Amtsblatt der EU veröffentlicht.
Der 01.01.2026 markiert insofern den Beginn der Frist von drei Jahren, innerhalb der die in Anhang IV zur Verordnung (EU) 2025/2455 genannten Chemikaliendaten in die gemeinsame Datenplattform aufgenommen werden müssen.
Nach Art. 4 Abs. 1 der Verordnung (EU) 2025/2455 wird durch die Kommission bis zum 02.07.2026 ein Umsetzungsplan im Wege eines Durchführungsrechtsakts, in dem die Datensätze von Chemikaliendaten, die in die gemeinsame Datenplattform aufgenommen werden sollen, zusammen mit einem Zeitplan für ihre Aufnahme festgelegt werden.
Zudem gilt ab 01.01.2026 eine Verpflichtung für Forschende oder Forschungskonsortien, die durch Rahmenprogramme der Union oder nationale Programme finanziert werden, Daten zur Verfügung zu stellen; an die EUA in Bezug auf Human-Biomonitoring-Daten und an die ECHA in Bezug auf einschlägige Daten zur ökologischen Nachhaltigkeit.
Besondere Relevanz wird auch die nach Art. 23 der Verordnung (EU) 2025/2455 einzurichtenden „Beobachtungsstelle“ für bestimmte Chemikalien oder Chemikaliengruppen entfalten. Hierzu wird die Europäische Kommission bis zum 02.07.2026 eine Liste von Chemikalien verabschieden und veröffentlichen, die einer ergänzenden Prüfung unterzogen werden sollen.
F. Fazit und Ausblick
Die vielfältigen Änderungen und Nachjustierungen machen das Chemikalienrecht auch im Jahr 2026 zu einer komplexen, anspruchsvollen und herausfordernden Materie. Die jüngsten „Korrekturmaßnahmen“ der Europäischen Kommission etwa zur SCIP-Datenbank, zur CLP und zur BPR stärken dabei nicht gerade diejenigen Unternehmen, die sich frühzeitig um Rechtskonformität bemüht haben.
Ungeachtet dessen bleibt es allerdings dabei, dass Unternehmen die vielfältigen Änderungen sorgfältig im Blick behalten müssen. Mehr noch: Jenseits der Änderungen in den zentralen Rechtsakten der europäischen Chemikalienregulierung treten vielfältige Regelungen hinzu, die ihrerseits auf bestimmte Gefahreneigenschaften von Stoffen in Produkten abstellen, hierzu Verkehrs- und Verwendungsverbote oder auch Transparenzerfordernisse etablieren. Entsprechende Vorgaben in ESPR, PPWR und vielen weiteren Regelungen unterstreichen dies. Das Chemikalienrecht tritt damit ebenso nachdrücklich wie abschließend den Beweis an, dass es sich um eine horizontale Regelungsmaterie handelt, die Unternehmen aus allen Branchen, allen Stufen in der Lieferkette und aller Größen betrifft. Umso wichtiger bleibt die Auseinandersetzung mit den fortwährenden Änderungen und die Entwicklung einer belastbaren unternehmensinternen Sensorik, um bestehende Handlungspflichten und (Haftungs-)Risiken ebenso frühzeitig zu erkennen, wie potentielle Chancen, die mit regulatorischen Änderungen verbunden sein können.
Haben Sie zu dieser News Fragen oder wollen Sie mit dem Autor über die News diskutieren? Kontaktieren Sie gerne: Martin Ahlhaus