In besonderer Weise gilt dies aufgrund einer zunehmenden Tendenz des Gesetzgebers, verschiedene Regelungsbereiche explizit miteinander zu verzahnen – man denke etwa an die Einbeziehung „besorgniserregender Stoffe“ in die Regelungssystematik der Verordnung (EU) 2024/1781 („ESPR“) oder auch an die Relevanz von verbotenen „chemischen Stoffen“ für die Bewertung des Risikoniveaus nach Anhang II Ziffer 4.1 d) zur Delegierten Verordnung (EU) 2024/3173.
Die noch ausstehende Verabschiedung des Regelungspakets zum OSOA-Ansatz („one substance – one assessment“ / „ein Stoff – eine Bewertung“) wird diesen Trend weiter stützen. Hier sind neben einer einheitliche Datenplattform für Informationen zu Stoffen auch die Neuzuweisung von Aufgaben u.a. an die Europäische Chemikalien-Agentur („ECHA“) vorgesehen, für welche zugleich auch eine neue Grundverordnung erlassen werden soll.
Die Bedeutung stoffbezogener Anforderungen wird dadurch weiter erhöht. Jenseits dieser künftigen Regelungen kommt für das Jahr 2025 aber auch die Notwendigkeit der Beachtung und Umsetzung zahlreicher Rechtsänderungen aus den Vorjahren hinzu, die nunmehr Geltung beanspruchen. Der vorliegende Beitrag greift einige zentrale Aspekte heraus, die besonders im Blick zu behalten sind.
A. REACH
Hinsichtlich der REACH-Verordnung sind unterschiedliche Aspekte relevant, die in 2025 Beachtung verdienen.
I. Revision
Auch wenn der Prozess zuletzt doch deutlich ins Stocken geraten war, steht weiterhin eine Überarbeitung der Verordnung (EG) Nr. 1907/2006 („REACH“) an. Auch unter der neuen Kommission bleiben Bestrebungen zu einer Vereinfachung der rechtlichen Vorgaben fester Bestandteil der politischen Agenda. Die Anpassungen sollen dabei Teil eines künftigen „Chemicals Industry Package“ sein. Während aus Industriekreisen bereits umfangreiche Vorschläge erarbeitet und vorgelegt wurden, steht die Konkretisierung der politischen Agenda der Kommission in diesem Bereich noch aus. Es wird abzuwarten bleiben, ob und inwieweit die Kommission vormalige Überlegungen zur Überarbeitung von REACH wieder aufgreift oder auch modifiziert. Im Blickpunkt stehen hier etwa die Überarbeitung von Zulassungs- und Beschränkungsverfahren, einschließlich der Einführung eines Ansatzes für eine generische Risikobewertung, die Ausweitung von Registrierungspflichten (z.B. auf bestimmte Polymere) oder die Ausdehnung von Datenanforderungen. Auch die weitere Umsetzung von Anforderungen nach dem „safe and sustainable by design“-Konzept, zur Einführung von „non-toxic material cycles“ und der Etablierung eines „essential use concepts” werden im Rahmen der Überarbeitung von REACH weiterhin im Fokus stehen.
II. Stoff- und Dossierevaluierung
Die ECHA hat unter dem 10.12.2024 den Entwurf eines Updates des „Community Rolling Action Plan (CoRAP)“ für die Jahre 2025 bis 2027 vorgelegt. Für das Jahr 2025 sind danach vier bereits im CoRAP adressierte Stoffe zur weitergehenden Bewertung vorgesehen, während weitere vier Stoffe ergänzend für das Jahr 2025 aufgenommen wurden.
Die ECHA hat bereits darauf hingewiesen, dass Registranten der betroffenen Stoffe ihre jeweiligen Registrierungsdossiers überprüfen und nötigenfalls bis zum März 2025 ergänzen sollten, damit alle erforderlichen Informationen enthalten sind.
Darüber hinaus sollten sämtliche Registranten auch im Blick behalten, dass zum 01.05.2025 die Anwendung der mit der Delegierten Verordnung (EU) 2023/707 eingeführten Gefahrenklassen und die damit zusammenhängenden Gefahrenhinweise für ab diesem Termin in Verkehr gebrachte Stoffe verpflichtend wird. Die entsprechenden Vorgaben sollten daher auch im Rahmen von allfälligen Dossieraktualisierungen berücksichtigt werden.
III. Zulassungskandidatenliste
Die ECHA hat zuletzt bereits unter dem 07.11.2024 eine Aktualisierung der Kandidatenliste vorgenommen und mit Triphenyl phosphate (EC: 204-112-2, CAS: 115-86-6) einen weiteren Stoff aufgenommen. Seither umfasst die Kandidatenliste insgesamt 242 Einträge, die unmittelbar sowohl für die Kommunikation in der Lieferkette nach Art. 33 REACH wie auch für Meldungen in die SCIP-Datenbank zu beachten sind. Für etwaige Notifizierungspflichten nach Art. 7 Abs. 2 REACH gilt für den zuletzt aufgenommenen Stoff noch eine Übergangsfrist von weiteren sechs Monaten (vgl. Art. 7 Abs. 7 REACH).
Würde die ECHA der etablierten Praxis von zwei Aktualisierungen binnen 12 Monaten folgen, würde erst zur Mitte des Jahres eine weitere Ergänzung der Kandidatenliste zu erwarten sein. Allerdings ist die ECHA mit der Ergänzung der Kandidatenliste zum 07.11.2024 aus der üblichen Praxis ausgeschert und hat im Jahr 2024 eine zusätzliche, dritte Ergänzung der Liste (nach den Änderungen vom 23.01.2024 und 27.06.2024) vorgenommen. Die turnusmäßige Ergänzung der Kandidatenliste per Anfang 2025 steht gerade noch aus. Denn wie sich aus dem Protokoll zur 88. Sitzung des Ausschusses der Mitgliedstaaten vom 12.12.2024 ergibt, soll bereits zum 21.01.2025 eine weitere Ergänzung der Kandidatenliste vorgenommen werden, mit der die folgenden Stoffe ergänzend aufgenommen werden sollen:
- Octamethyltrisiloxane (EC: 203-497-4, CAS: 107-51-7);
- O,O,O-triphenyl phosphorothioate (EC: 209-909-9, CAS: 597-82-0);
- Reaction mass of: triphenylthiophosphate and tertiary butylated phenyl derivatives (EC: 421-820-9, CAS: 192268-65-8);
- Perfluamine (EC: 206-420-2, CAS: 338-83-0);
- Tris(4-nonylphenyl, branched and linear) phosphite (EC: -, CAS: -);
- 6-[(C10-C13)-alkyl-(branched, unsaturated)-2,5-dioxopyrrolidin-1-yl] hexanoic acid (EC: 701-118-1, CAS: 2156592-54-8).
Betroffene Unternehmen stellt dies vor einige Herausforderungen, da Kommunikationsprozesse in der Lieferkette in kurzer Folge nun erneut überprüft bzw. aktualisiert werden müssen.
IV. Zulassungspflichten
Für eine Reihe zulassungspflichtiger Stoffe gemäß Anhang XIV zu REACH wird im laufenden Jahr der Ablauftermin erreicht, d.h. der Termin, ab dem der jeweilige Stoff nicht mehr als solcher oder als Bestandteil von Gemischen verwendet werden darf, soweit hierfür nicht fristgerecht bereits vor dem 01.11.2023 ein entsprechender Zulassungsantrag gestellt wurde (vgl. hierzu schon unser Ausblick auf 2023) oder eine der wenigen generellen Ausnahmen eingreift. Betroffen sind:
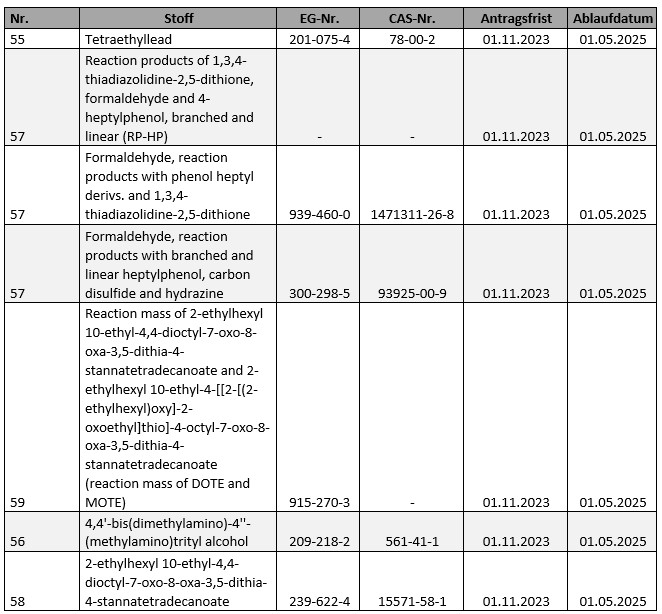
Erwähnenswert bleibt, dass ausweislich des Protokolls zur 88. Sitzung des Ausschusses der Mitgliedstaaten vom 12.12.2024 auch der Ansatz für die Priorisierung von Stoffen zur Aufnahme in den Anhang XIV eine Überarbeitung erfahren soll. Neben einer durchaus angebrachten, kritischen Überprüfung und ggf. Ergänzung der bisherigen Entscheidungsparameter wäre es dabei sicher wünschenswert, wenn im Priorisierungsverfahren zu einzelnen Entscheidungsprozessen auch mehr Transparenz an den Tag gelegt würde.
V. Beschränkungen
Für ein Reihe von Beschränkungen laufen im Jahr 2025 bisherige Ausnahme- oder Übergangsregelungen aus, etwa für
- die Verwendung von chrysotilhaltigen Diaphragmen in Elektrolyseanlagen (vgl. Nr. 6 in Anhang XVII zu REACH; Stichtag: 01.07.2025);
- die Verwendung von Blei und seinen Verbindungen in Erzeugnissen, die aus Polymeren oder Copolymeren des Vinylchlorids („PVC“) hergestellt sind, wenn die Bleikonzentration 0,1 Gew.-% oder mehr des PVC-Materials beträgt und soweit die Erzeugnisse zurückgewonnenes Weich-PVC enthalten (Eintrag Nr. 63 in Anhang XVII zu REACH; Stichtag: 28.05.2025);
- die Verwendung von C9-C14-PFCA, ihren Salzen und C9-C14-PFCA-verwandten Stoffen für (i) fotolithografische oder Ätzverfahren bei der Halbleiterherstellung, (ii) fotografische Beschichtungen von Filmen, (iii) invasive und implantierbare Medizinprodukte und (iv) bestimmte Feuerlöschschäumen (Eintrag Nr. 68 in Anhang XVII zu REACH; Stichtag 04.07.2025)
- die Verwendung von N,N-Dimethylformamid für das Inverkehrbringen zur Verwendung oder für die Verwendung als Lösungsmittel für das Trocken- und Nassspinnen synthetischer Fasern (Eintrag Nr. 76 in Anhang XVII zu REACH; Stichtag: 12.12.2025).
oder es treten weitergehende Verpflichtungen erstmals hinzu, wie etwa
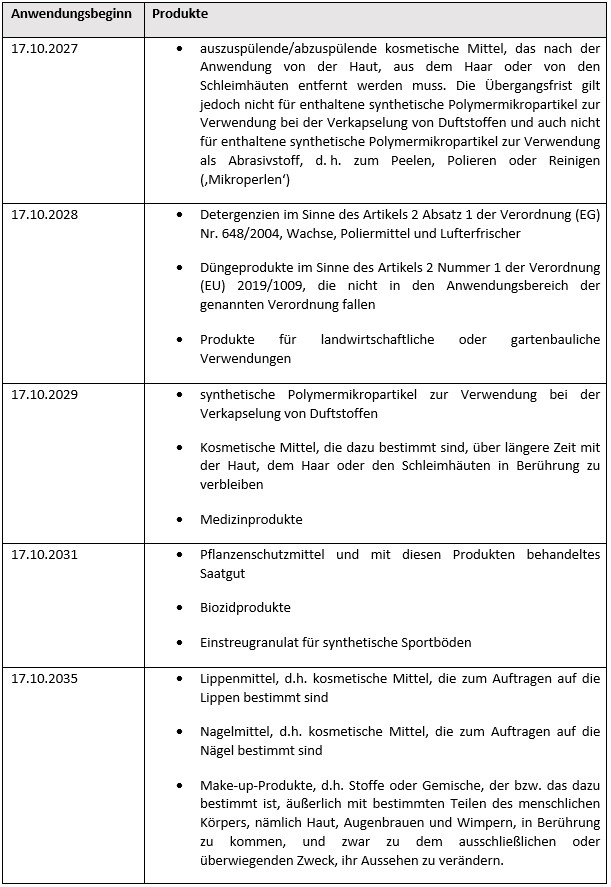
- die Verpflichtung der Lieferanten von synthetischen Polymermikropartikeln als solchen oder in Gemischen zur Verwendung in Industrieanlagen, künftig ergänzende Informationen und Hinweise weitergeben zu müssen (vgl. Eintrag Nr. 78 in Anhang XVII zu REACH, Stichtag: 17.10.2025);
- die Verpflichtung der Lieferanten von Produkten, die synthetische Polymermikropartikel in Form eines Lebensmittelzusatzstoffes in Verkehr bringen, Anweisungen für die Verwendung und Entsorgung für gewerbliche Anwender und die breite Öffentlichkeit zur Verfügung stellen, in denen erläutert wird, wie die Freisetzung synthetischer Polymermikropartikel in die Umwelt verhindert werden kann; die gleiche Verpflichtung trifft Lieferanten von synthetischen Polymermikropartikel,
- die durch technische Mittel so eingeschlossen sind, dass eine Freisetzung in die Umwelt verhindert wird, wenn sie während der vorgesehenen Endanwendung vorschriftsmäßig verwendet werden;
- deren physikalische Eigenschaften während der vorgesehenen Endanwendung dauerhaft so verändert werden, dass das Polymer nicht mehr in den Anwendungsbereich dieses Eintrags fällt;
- die während der vorgesehenen Endverwendung dauerhaft in eine feste Matrix integriert werden. (vgl. Eintrag Nr. 78 in Anhang XVII zu REACH, Stichtag: 17.10.2025).
Unabhängig davon bleibt selbstverständlich der weitere Fortgang der Beratungen zum Vorschlag zur Beschränkung von PFAS zu verfolgen. Für das laufende Jahre stehen weitere Diskussionen zu sektorspezifischen Ausnahmen und Übergangsregelungen an und auch neue Regelungsansätze sollen ausweislich des zum Ende des vergangenen Jahres veröffentlichten Updates diskutiert werden.
B. CLP
Nachdem im Jahr 2023 bereits durch einen Delegierten Rechtsakt neue Gefahrenklassen (EDs, PBTs, PMTs etc.) eingeführt wurden, steht das Jahr 2025 ganz im Zeichen der Vorbereitung auf die Umsetzung der überarbeiteten Anforderungen der Verordnung (EG) Nr. 1272/2008 („CLP“), die jüngst durch die Verordnung (EU) 2024/2865 geändert wurde. Diese, am 20.11.2024 im Amtsblatt der EU veröffentlichte Regelung ändert u.a. spezifische Vorgaben für die Einstufung von Stoffen mit mehreren Bestandteilen, sieht eine Neufassung von Art. 10 CLP betreffend Konzentrationsgrenzwerte, M-Faktoren und Schätzwerte Akuter Toxizität für die Einstufung von Stoffen und Gemischen vor und führt spezifische Vorgaben für die Abgabe gefährlicher Stoffe und Gemische über sogenannte „Nachfüllstationen“ ein.
Der praktisch bedeutsamste Änderungskomplex betrifft allerdings Aspekte der Kennzeichnung. Die Vorgaben für die Gestaltung von Kennzeichnungsetiketten (bislang z.T. bereits über die entsprechende Leitlinie adressiert) wurden nun explizit in den Anhang I zur CLP integriert (etwa zu Farbe, Schriftart und -größe, Zeilenabstand etc.). Auch die Regelungen für die Aktualisierung von Kennzeichnungsetiketten in Art. 30 CLP wurden aktualisiert und präzisiert.
Das Chemikalienrecht war richtigweise schon immer eine Querschnittsmaterie des Produktrechts. Die Neufassung der CLP greift dies nun auch konkret auf und sieht etwa in Art. 25 Abs. 9 CLP vor, dass Kennzeichnungselemente, die sich aus Anforderungen anderer Rechtsakte der Union ergeben, in den Abschnitt mit ergänzenden Informationen auf dem Kennzeichnungsetikett (nach CLP!) aufgenommen werden müssen. Damit werden auch derartige Vorgaben uno actu sogleich den spezifischen Gestaltungsanforderungen und Formatvorgaben der neu gefassten CLP unterworfen. Denn auch der Abschnitt mit ergänzenden Informationen ist ein Element des Kennzeichnungsetiketts und unterliegt deshalb auch den Vorgaben für die Gestaltung nach Abschnitt 1.2.1.5 in Anhang I Teil 1 zur CLP.
Schon dies zeigt, dass auf die Lieferanten von gefährlichen Stoffen und Gemischen in den nächsten Jahren erhebliche Umstellungen zukommen, die einer frühzeitigen Vorbereitung bedürfen. Zwar wurden mit Verordnung (EU) 2024/2865 sowohl ein späterer Geltungsbeginn der neuen Anforderungen vorgesehen (01.07.2026 bzw. 01.01.2027) und zudem für bereits in der Lieferkette befindliche „Altbestände“ eine zusätzliche Abverkaufsregelung bis zum 01.07.2028 bzw. 01.01.2029 eingeführt. Ware, die nach dem Geltungsbeginn erstmals in Verkehr gebracht wird oder aber nach Ablauf der Abverkaufsfristen in Verkehr gebracht werden soll, muss hingegen zur Vermeidung eines Verkehrsverbots (vgl. Art. 4 Abs. 10 CLP) die neuen Anforderungen erfüllen (vgl. Art. 61 Abs. 7, 8 CLP). Auch wenn die Regelungen vergleichsweise großzügig anmuten – für eine Bereinigung gesamter Lieferketten und etwaiger Lagerbestände bleibt der Zeitrahmen ambitioniert.
C. Biozide
Im Biozidrecht sind für das Jahr 2025 sowohl EU-rechtlich Entwicklungen in der BPR, als auch nationale Entwicklungen in der ChemBiozidDV zu berücksichtigen.
I. BPR
Auf europäischer Ebene gilt ein Hauptaugenmerk weiterhin der Fortführung des Arbeitsprogramms unter der Verordnung (EU) Nr. 528/2012 („BPR“), nebst entsprechender Fortschreibung und Aktualisierung der maßgeblichen delegierten Verordnung (EU) Nr. 1062/2014. Auf allfällige Fristen für 2025 weist die ECHA in gewohnter Weise hin.
In diesem Zusammenhang sind in weiterhin anhängigen Verfahren auf Wirkstoffgenehmigung bzw. Produktzulassung auch ergänzende Datennachforderungen zu verzeichnen. Antragsteller sollten sich auch für 2025 hierauf einstellen, soweit die bewertenden Behörden aufgrund der Anpassungen und Aktualisierungen von Leitlinien und Empfehlungen für die Bewertung dafür Anlass sehen. Besondere Relevanz werden dabei etwa auch die „BPC Recommendations“ für die Bewertung von sog. „in-situ“-Systemen haben, die für das Frühjahr 2025 erwartet werden. Mehr als 12 Jahre nach Inkrafttreten der BPR sollen hierdurch die Rahmenbedingungen für die Datenanforderungen und Bewertungen von „in-situ“-Systemen in einer Weise konkretisiert werden, die den tatsächlichen und technischen Besonderheiten der Vor-Ort-Herstellung von Biozidprodukten Rechnung trägt – auch wenn sich im Detail offenbart, wie wenig die BPR derartige Systeme im Blick hatte, obschon diese ausdrücklich von Beginn an in den Anwendungsbereich einbezogen waren. Für praxistaugliche Ansätze werden die rechtlichen Vorgaben der BPR mindestens sehr deutlich „gedehnt“ werden müssen. Insgesamt ist es allerdings zu begrüßen, dass sich die ECHA und die zuständigen Behörden der Mitgliedstaaten dem Thema mit großem Engagement gewidmet haben, um den entsprechenden Verfahren – auch im Interesse der Antragsteller – mehr Klarheit zu verleihen.
II. ChemBiozidDV
Auf nationaler Ebene hat das Jahr 2025 bereits mit dem Eingreifen des Verbots von Selbstbedienungsangeboten und dem Anwendungsbeginn weiterer Verkaufsbeschränkungen für bestimmte Biozidprodukte nach der ChemBiozidDV begonnen. Seit dem 01.01.2025 gilt für Biozidprodukte,
- wenn eine oder mehrere Verwendungen dieser Produkte gemäß der durch die Zulassung entsprechend der BPR vorgegebenen Kennzeichnung nicht durch die breite Öffentlichkeit gestattet sind; oder
- die ohne Zulassung nach der BPR aufgrund von anwendbaren Übergangsvorschriften weiterhin verkehrsfähig sind und den Produktarten 14, 18 oder 21 nach Anhang V der BPR zugeordnet sind
ein Selbstbedienungsverbot. Das heißt, diese Produkte dürfen nur in einer Form angeboten und abgegeben werden, in welcher der Käufer keinen freien Zugang zu dem Biozidprodukt hat (vgl. § 10 Abs. 1 Nr. 2 ChemBiozidDV).
Darüber hinaus sind dem Erwerber weitere mündliche Belehrungen zu erteilen (vgl. § 10 Abs. 2 i. V. m. § 11 ChemBiozidDV), es gelten weitere Anforderungen für den Online- und Versandhandel (§ 12 ChemBiozidDV) und der Verkauf darf nur von einer Person vermittelt werden, die die Anforderungen an die für den Verkauf erforderliche Sachkunde erfüllt (§ 13 ChemBiozidDV).
Desweiteren dürfen Biozidprodukte, die Übergangsbestimmungen entsprechend der BPR unterliegen und den Produktarten 7, 8 oder 10 nach Anhang V der BPR zugeordnet sind, nur in den Verkehr gebracht werden, wenn durch organisatorische Maßnahmen sichergestellt ist, dass die weitere mündliche Unterweisung des Abnehmers (vgl. § 10 Abs. 2 in Verbindung mit § 11 ChemBiozidDV) durch eine Person erfolgt, die die Anforderungen an die für den Verkauf erforderliche Sachkunde (§ 13 ChemBiozidDV) erfüllt.
D. POP
Für das Jahr 2025 sind weitere Anpassungen der Verordnung (EU) 2019/1021 („POP“) zu erwarten, nachdem die Liste der in das zugrunde liegenden Stockholmer Abkommen einbezogenen Stoffe bereits erweitert wurde. Die entsprechende Anpassung des Rechtsrahmens der EU muss insofern noch nachgezogen werden.
Jenseits dieser eher formalen Nachjustierung des europäischen Rechtsrahmens, sorgt jedoch ein neueres Interpretationsdokument der Europäischen Kommission für einiges Aufsehen. Das Dokument legt ein neues Verständnis für die Ausnahme nach Art. 4 Abs. 2 POP für Stoffe vor, die in Erzeugnissen vorhanden sind, die vor oder zu dem Zeitpunkt, seit dem die POP oder ihre Vorgängerregelung auf diese Stoffe Anwendung findet — je nachdem, welcher Zeitpunkt früher eintrat —, bereits verwendet wurden. Diese Ausnahmeregelung wurde bislang aufgrund des spezifisch definierten Begriffs der „Verwendung“ (vgl. Art. 2 Nr. 6 POP unter Verweis auf die Definition des Begriffs in Art. 3 Nr. 24 REACH) sehr weit ausgelegt, da die Verwendung gleichsam jeden Gebrauch (einschließlich etwa der Lagerung) umfasst.
Nunmehr soll eine Verwendung im Sinne von Art. 4 Abs. 2 POP aber nur noch dann vorliegen, wenn sich das betroffene Produkt bereits im Besitz des Endnutzer befindet. Dies hat zur Folge, dass Ware, die sich – z.B. als Lagerware bei einem Händler – noch in der Lieferkette befindet, den Endnutzer aber noch nicht erreicht hat, nicht mehr von der Ausnahme profitieren würde. Derartige Ware wäre vielmehr nicht länger verkehrsfähig und müsste sogar als Abfall entsorgt werden (vgl. Art. 5 Abs. 1 POP).
Die Auswirkungen dieser Neuinterpretation können in ihrer Dimension derzeit noch kaum übersehen werden. Natürlich wird die praktische Relevanz auch von der etwaigen Vollzugsdichte abhängen. Schon der (unerwartete) Wegfall der Verkehrsfähigkeit von Warenbeständen wird aber im laufenden Jahr in zahllosen Lieferbeziehungen für erhebliche Diskussionen sorgen, wenn vertragliche Ansprüche oder generelle Anforderungen aus der Material und Product Compliance in den Blick genommen werden.
Fazit und Ausblick
Das Chemikalienrecht bleibt auch im Jahr 2025 eine anspruchsvolle Materie, die Unternehmen fortgesetzt vor erhebliche Herausforderungen stellt. Vergleichsweise niederschwellige Änderungen, die oft außerhalb der Wahrnehmungssphäre betroffener Unternehmen umgesetzt werden – z.B. durch bloße Änderung der Einstufung eines Stoffes, die Ausweitung von Verbotsregelungen auf Stoffgruppen oder Stoffe/Gemische mit bestimmten Eigenschaften oder auch die Änderung bloßer Interpretationen – können erhebliche wirtschaftliche Auswirkungen entfalten. Ohne hinreichende Sensorik zur frühzeitigen Erkennung solcher Entwicklungen im Bereich der „material compliance“ werden Unternehmen in Produktion und Handel perspektivisch nicht mehr zielgerichtet am Markt agieren können – oder gar konkret die frühzeitige Verteidigung Ihrer Interessen in entsprechenden Konsultations-, Antrags- oder auch Rechtsbehelfsverfahren in Angriff nehmen können.
Haben Sie zu dieser News Fragen oder wollen Sie mit dem Autor über die News diskutieren? Kontaktieren Sie gerne: Martin Ahlhaus